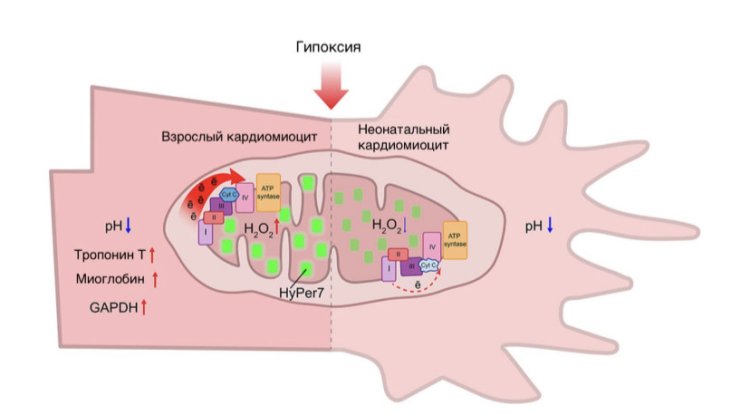
Разная чувствительность к условиям гипоксии у неонатальных и зрелых кардиомиоцитов. Источник: Юлия Храмова, биологический факультет МГУ
Команда российских исследователей изучила окислительно-восстановительный статус неонатальных и взрослых кардиомиоцитов в условиях кислородно-глюкозной депривации. В ходе исследования впервые было использовано сочетание рамановской микроспектроскопии и флуоресцентной микроскопии с применением генетически кодируемых сенсоров, чувствительных к изменению уровня пероксида водорода и рН. Ученые обнаружили различия в реакции неонатальных и взрослых кардиомиоцитов на условия недостатка кислорода, что приближает к пониманию механизмов устойчивости клеток к гипоксии, возникающей при ишемической болезни сердца.
Результаты исследования опубликованы в журнале Free Radical Biology and Medicine. Проект выполнен в рамках деятельности Междисциплинарных научно-образовательных школ Московского университета «Молекулярные технологии живых систем и синтетическая биология» (соглашение 23-Ш04-48), проект «Генетически кодируемые инструменты для спектроскопических и оптических методов исследования в биологии и медицине».
Согласно данным Всемирной организации здравоохранения, ишемическая болезнь сердца — одна из главных причин смертности населения. Она вызвана нарушениями в кровоснабжении сердца и может проявляться в виде инфаркта миокарда, стенокардии, сердечной недостаточности. При ограниченном поступлении крови к клеткам они получают меньшее количество кислорода, то есть находятся в состоянии гипоксии.
Считается, что многие болезни сердца вызваны окислительным стрессом. Однако активные формы кислорода (АФК), в частности, пероксид водорода, выполняют функции сигнальных молекул – участников различных сигнальных каскадов. В норме количество АФК контролируется антиоксидантными системами, которые перерабатывают их в менее токсичные для организма формы. Избыток активных форм кислорода опасен тем, что эти соединения являются высоко реакционноспособными и вступают в реакции с липидами, белками и ДНК, вызывая их повреждение. Если по каким-либо причинам баланс между генерацией АФК и работой антиоксидантных систем нарушен, это приводит к окислительному стрессу и, как следствие, развитию заболеваний.
Один из основных источников активных форм кислорода в кардиомиоцитах — мышечных клетках сердца - дыхательная (или электрон-транспортная) цепь митохондрий. Митохондрии являются маленькими фабриками по созданию энергии, которая возникает как раз в результате реакций дыхательной цепи. При ишемической болезни сердца нарушается работа участников электрон-транспортной цепи (ЭТЦ), из-за чего они продуцируют избыточное количество АФК. Считается, что причиной некорректной работы является не сама гипоксия, а реперфузия - восстановление притока крови к органу, возникающая при восстановлении.
Разработка генетически кодируемых сенсоров – белковых молекул, состоящих из сенсорного и репортерного доменов, меняющих конформацию в присутствии целевых молекул или ионов, что отражается в изменении флуоресцентного сигнала, - позволила вывести исследования, в частности, окислительного стресса на новый уровень. Так, например, для изучения развития окислительного стресса в условиях in vivo используются сенсоры из семейства HyPer. Для исследования изменений рН используют сенсор SypHer3.
Несмотря на актуальность изучения ишемической болезни сердца, влияние АФК на развитие этой патологии мало исследовано. Команда ученых, в которую вошли сотрудники биологического факультета, решила подробнее рассмотреть влияние окислительного стресса на кардиомиоциты, выделенные из сердец новорожденных и взрослых крыс. В полученные культуры клеток при помощи вирусной доставки помещали конструкции, содержащие ген HyPer7 или SypHer3 и сигнальную последовательность, обеспечивающую локализацию в митохондриях.
Ученые проследили динамику изменения флуоресцентного сигнала сенсоров при гипоксии и последующей реперфузии в неонатальных и зрелых кардиомиоцитах. Чтобы охарактеризовать физиологические и биохимические параметры клеток в указанных условиях, было проанализировано изменение содержания миоглобина, тропонина I и тропонина T. Данные белки сердечной мышцы участвуют в создании резерва кислорода. Было показано, что при гипоксии их концентрация увеличивается. Также при помощи рамановской микроспектроскопии изучили окислительно-восстановительный статус кардиомиоцитов. Применение этого метода позволяет оценить состояние молекул, в частности, электрон-транспортной цепи митохондрий.
В условиях гипоксии происходило увеличение генерации пероксида водорода в зрелых кардиомиоцитах, в то время как в неонатальных клетках наблюдали обратное - понижение уровня H2O2 относительно базового уровня. Данные наблюдения коррелируют с данными о состоянии ЭТЦ митохондрий в разных клетках, полученных методом Рамановской микроспектроскопии. Также было обнаружено, что в условиях гипоксии в обоих типах клеток происходило снижение рН. На основании этого ученые сделали вывод, что ацидоз является общим защитным механизмом. Анализ количества митохондрий, а также содержания тропонина I, тропонина Т и миоглобина показал, что при гипоксии у взрослых организмов происходило повышение показателей, а в неонатальных их уровень не изменялся.
«При исследовании влияния гипоксии на кардиомиоциты впервые было использовано сочетание флуоресцентной микроскопии с применением генетически кодируемого сенсора, детектирующего пероксид водорода, и рамановской микроспектроскопии, позволяющей оценить состояние дыхательной цепи митохондрий. Это позволило сделать выводы о генерации активных форм кислорода за счет митохондрий. На основании данных, полученных при уникальной комбинации методов, было установлено, что условия, приводящие к генерации супероксид-анион радикала в дыхательной цепи митохондрий, могут не влиять на образование пероксида водорода. Полученные результаты показывают, что следует пересмотреть участие пероксида водорода в окислительном стрессе, развивающемся в условиях гипоксии», — дополнила Юлия Храмова, один из авторов исследования, старший научный сотрудник кафедры биохимии биологического факультета МГУ.
Информация и фото предоставлены пресс-службой МГУ