Подготовка образцов эмульсионных микрогелей для изучения загрузочного количества красителя спектрофотометрическим методом. Источник: Оксана Майорова
Исследователи синтезировали микрогели, которые позволят доставлять препараты для лечения хронической болезни почек непосредственно в пораженный орган. Состав, сочетающий природные белки и масла, оказался нетоксичен для разных типов клеток, присутствующих в почках. Эксперименты также показали, что микрогели можно вводить в кровоток, поэтому такой подход позволит быстро и с минимальным дискомфортом для пациента точечно доставлять лекарства в почки. Результаты исследования, поддержанного грантами № 23-75-10070 и № 21-75-10042 Российского научного фонда (РНФ), опубликованы в журнале Optical Materials.
Хроническая болезнь почек — это общее название для целого ряда заболеваний, при которых нарушается работа этих органов. Почки хуже фильтруют кровь, что приводит к накоплению в ней продуктов обмена веществ и токсинов, увеличению кислотности крови, повреждению тканей и повышению давления. Препараты для лечения хронической болезни почек часто довольно токсичны и действуют на весь организм, из-за чего могут навредить другим органам. Поэтому ученые разрабатывают системы, с помощью которых лекарства можно было бы доставлять непосредственно в пораженный орган.
Ученые из Сколковского института науки и технологий (Москва), Саратовского государственного университета (Саратов) и Национального исследовательского Мордовского государственного университета имени Н.П. Огарёва (Саранск) синтезировали микрогели для доставки лекарств в почки. За основу авторы взяли сывороточный протеин — белковую смесь, получаемую из сыворотки молока. Ее смешали с льняным маслом и безопасным для живых организмов светящимся (флуоресцентным) красителем, который нужен был для дальнейшего наблюдения за накоплением и перемещением микрогелей после их введения в ткани. В результате сформировались эмульсионные микрочастицы, которые состояли из масляной фазы, покрытой белковой оболочкой. Такой состав благодаря своим физико-химическим свойствам при введении в организм транспортируется именно к целевым органам — почкам.
Авторы исследовали токсичность полученных микрогелей, добавив их на трое суток к культурам различных клеток — эмбриональных клеток почки человека, фибробластов (клеток соединительной ткани), стволовых и иммунных клеток. Эти типы были выбраны потому, что они в норме присутствуют в почках животных и человека. Эксперимент показал, что микрогели даже в высоких концентрациях не снижают жизнеспособность клеток.
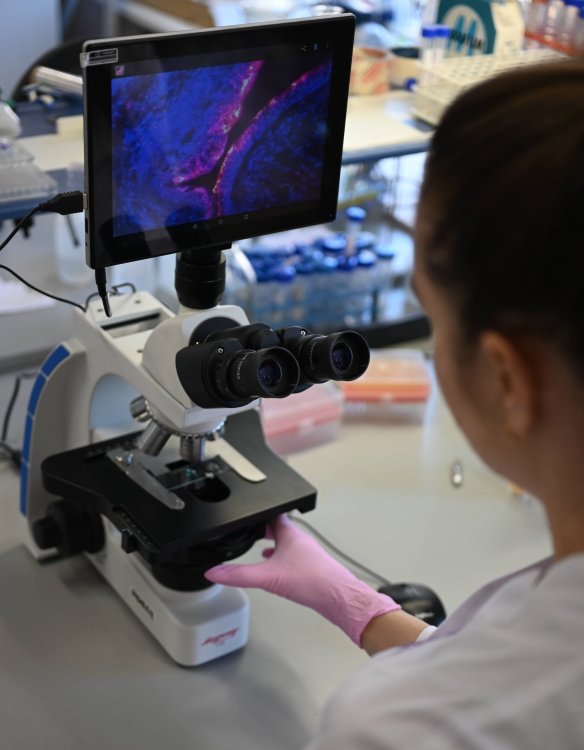
Оптическая микроскопия эмульсионных микрогелей в тканях органов мочевыделительной системы. Источник: Оксана Майорова
Затем исследователи ввели микрогели мышам, при этом животных разделили на три группы. Первой группе суспензию микрогелей ввели в хвостовую вену, второй — в левую почечную артерию. В третью группу вошли контрольные животные, которые не получили препарат.
Наблюдение за распределением микрогелей в организме мышей показало, что вне зависимости от способа введения препарат уже в течение пяти минут после инъекции с кровью поступает в почки и накапливается там. В то же время артериальное введение, вопреки ожиданиям, приводит к большему накоплению микрогелей в противоположной почке, а не в той, в которую непосредственно их вводили. Такой неожиданный эффект во многом связан с реакцией кровотока на локальное введение микрогелей. Однако это не оказывает повреждающего действия ни на почки, ни на другие жизненно важные органы. Спустя примерно сутки значительная часть разрушенных и переработанных ферментами микрогелей выводится из организма. Это свойство позволит локально высвобождать лекарственное средство, доставляемое в орган предложенной системой. Сами же препараты для лечения хронической болезни почек планируется химически «пришивать» к поверхности микрочастиц или загружать внутрь масляных капель.
«Предлагаемая система доставки накапливается в почках, что позволит избежать попадания лекарств в другие органы. При этом она нетоксична благодаря тому, что состоит из природных безопасных для живых клеток компонентов. Кроме того, наши эксперименты показали, что микрогели можно вводить внутривенно — наиболее быстрым, точным и удобным для пациента способом. В дальнейшем мы планируем протестировать загруженные лекарством микрогели для лечения различных заболеваний почек инфекционной, иммунологической и онкологической природы», — рассказывает автор статьи и руководитель проекта, поддержанного грантом РНФ, Ольга Синдеева, кандидат биологических наук, старший научный сотрудник Центра нейробиологии и нейрореабилитации имени Владимира Зельмана Сколковского института науки и технологий.
Информация и фото предоставлены пресс-службой Российского научного фонда