Некоторые белки в организме человека легко блокировать с помощью лекарств: в их структуре есть очевидное место, куда лекарство может попасть, как ключ в замок. Но на другие белки воздействовать сложнее, у них нет четких мест связывания с лекарством.
Чтобы разработать препарат, блокирующий белок, связанный с раком, ученые из Scripps Research воспользовались подсказкой паралога, или «близнеца», этого белка. Используя инновационные методы химической биологии, ученые определили место на паралоге, пригодное для связывания с лекарством, а затем использовали эти знания для определения характеристик лекарств, которые связываются с аналогичным, но более сложным для обнаружения местом на его близнеце. В итоге были найдены препараты, которые связывались только с интересующим их белком, а не с его очень похожим собратом.
Подход, описанный в журнале Nature Chemical Biology и получивший название «paralog hopping», может открыть новые места связывания для препаратов и помочь в разработке лекарств в целом, поскольку почти половина белков в клетках человека, в том числе многие, участвующие в развитии рака и аутоиммунных заболеваний, имеют такие паралоги.
«Этот метод может быть полезен в тех случаях, когда у вас есть паралоги, и вы пытаетесь найти новое лекарство для одного из них», — говорит старший автор Бенджамин Краватт, заведующий кафедрой биологии и химии в Scripps Research. «Возможность направить действие одного паралога на другой — важная цель в разработке лекарств, поскольку два паралога часто выполняют разные функции».
Многие гены дублировались в ходе эволюции, что привело к появлению нескольких копий в геноме человека. В некоторых случаях копии несколько отличаются друг от друга по последовательности, что превращает их соответствующие белки в паралоги. Эти паралоги белков остаются очень похожими по структуре и часто выполняют избыточные или дублирующие функции в клетках.
В последние годы исследовательская группа Краватта разработала подход к созданию лекарств, которые связываются с аминокислотой цистеином — строительным блоком белка с уникальными, высокореактивными химическими свойствами. Метод ученых использует цистеины в качестве оптимального места для постоянного присоединения лекарств к белку, зачастую инактивируя его. Однако не все белки имеют доступные цистеины. В паралогических парах один белок может иметь цистеин, который можно использовать в качестве лекарства, а другой — нет.
«Мы начали с идеи, что если вы знаете, как лечить один белок, то сможете понять, как лечить его паралог аналогичным образом», — говорит Юаньцзинь Чжан, первый автор работы.
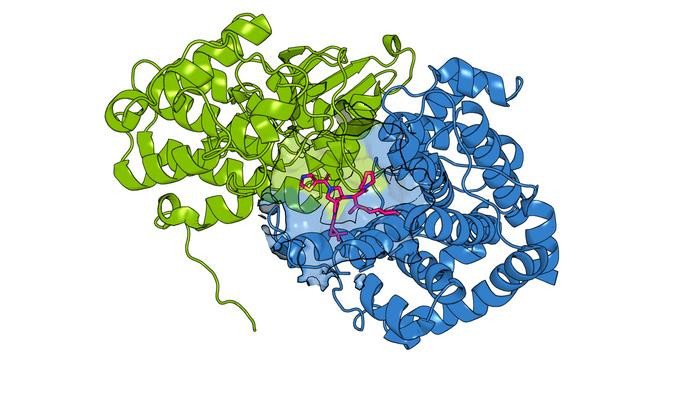
В качестве тестового примера команда рассмотрела пару паралогов, известных как CCNE1 и CCNE2. Было обнаружено, что оба белка чрезмерно активны при раке груди, яичников и легких. Однако ученые подозревали, что эти два белка играют несколько разные роли. Команда предположила, что отключение только одного белка может сделать лечение некоторых видов рака более эффективным.
Однако для проверки этой гипотезы было сложно разработать препараты, воздействующие на белки CCNE1 и CCNE2. Краватт, Чжан и их коллеги знали, что в CCNE2 есть цистеин, на который можно воздействовать лекарствами, а в CCNE1 его нет. Если бы они смогли найти лекарства, которые связывались бы с одним и тем же местом на CCNE1, даже в отсутствие цистеина, они бы предположили, что белок отключится.
Сначала ученые встроили цистеин в CCNE1, имитируя место связывания лекарств, обнаруженное в CCNE2. Затем они использовали этот неоцистеин для поиска лекарств, которые связываются с CCNE1. После ученые проверили библиотеку других химических соединений на способность конкурировать с этим лекарством в связывании с CCNE1. Команда предположила, что некоторые из соединений, конкурирующих за одно и то же место, будут связываться способами, не зависящими от цистеина.
И действительно, исследователи обнаружили несколько соединений, которые могли связываться с одним и тем же участком CCNE1 даже после удаления цистеина. Другие соединения не связывались с CCNE2. Некоторые также выполняли противоположные функции, стабилизируя молекулу, чтобы она могла быть более активной, чем обычно. Структурные исследования показали, что соединения CCNE1 связываются с криптическим карманом, который ранее не был известен как лекарственный. Команда говорит, что этот подход подчеркивает важность поиска лекарств различными, творческими способами.
«Если бы мы просто искали соединения с определенной функцией, мы бы не выявили все эти разнообразные функциональные молекулы, а если бы мы просто посмотрели на структуру CCNE1, мы бы вообще не нашли этот связывающий карман», — говорит Чжан.
Необходимо провести дополнительные исследования, чтобы выяснить, могут ли новые соединения быть полезны для лечения рака или других заболеваний, в которых CCNE1 играет определенную роль. Далее ученые планируют применить свой метод смены паралогов к другим парам белков, важных для опухолеобразования.
[Фото: Scripps Research / Benjamin Cravatt]