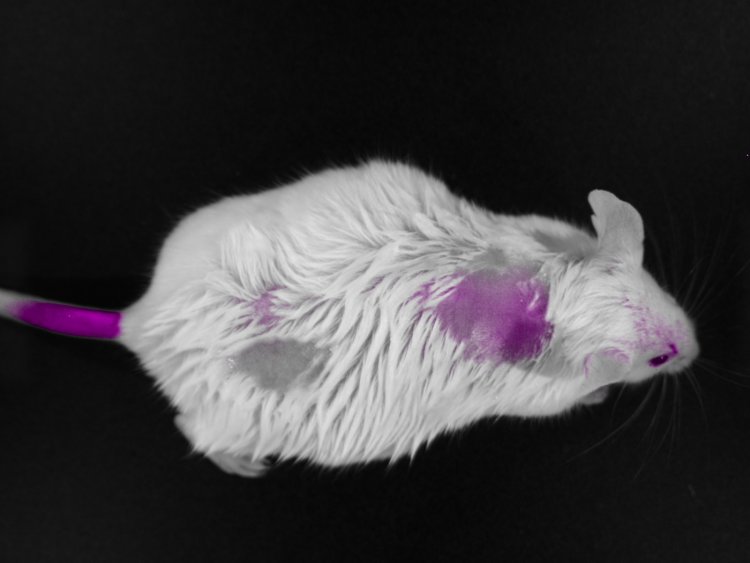
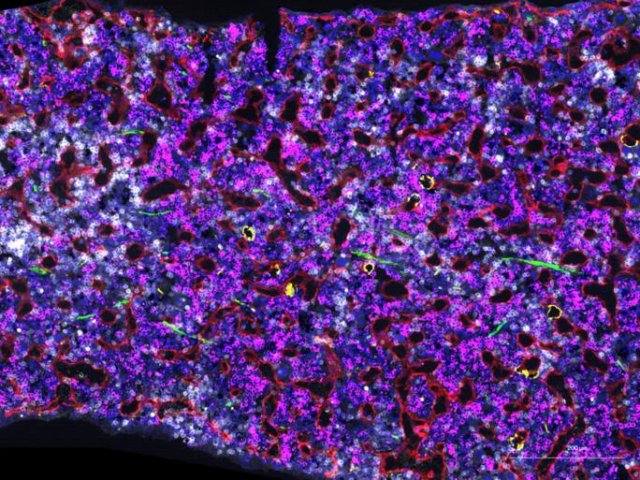
Красноярские ученые совместно с коллегами создали контрастный агент на основе аптамеров для интраоперационной визуализации и точного определения места распространения опухолевых клеток мозга. Эксперименты подтвердили потенциал нового контрастного агента для визуализации глиом. Он обеспечивает контрастность и яркость изображения, позволяя отличить опухолевые ткани от здоровых участков мозга. Результаты исследования опубликованы в журнале Journal of the American Chemical Society.
Глиома — злокачественная опухоль мозга, которая имеет инфильтративную природу, то есть проникает и распространяется в окружающие здоровые ткани, что затрудняет определение ее границ и делает невозможным полное удаление хирургическим путем. Несмотря на это, одним из решающих и важных этапов терапии глиомы остается ее резекция. Чтобы повысить показатели выживаемости пациентов и свести к минимуму рецидив опухоли, крайне важно тщательно удалить все злокачественные клетки, рассеянные в здоровой ткани. В связи с этим точное определение границ опухоли во время операции является ключевым фактором для успешной резекции. Существующие препараты для интраоперационной визуализации и точного определения локализации опухолевых клеток в реальном времени имеют ощутимые недостатки, среди которых ошибочное окрашивание воспаленных или отечных областей, похожих на опухоль, или, наоборот, неточное подсвечивание опухолевых тканей из-за затрудненного доступа к ним.
Чтобы преодолеть вышеупомянутые проблемы, ученые Красноярского научного центра СО РАН и Красноярского государственного медицинского университета им. проф. В.Ф. Войно-Ясенецкого и ООО «Аптамерлаб» совместно с коллегами из Томска и Владивостока разработали новый контрастный агент на основе меченных инфракрасным красителем аптамеров для визуализации опухолей головного мозга. Его можно использовать для точного определения места распространения опухолевых клеток. Разработкой заинтересовалась фарм-компания «Р-ФАРМ», с которой подписано соглашение о намерениях по продвижению препарата в клиническую практику.
В настоящее время существуют специфические контрастные агенты на основе антител и пептидов для интраоперационной диагностики глиальных опухолей, но они почти недоступны для хирургов, и даже неспецифические красители, такие как аласенс или индоцианин зеленый, мало используются. Однако антитела обладают рядом несовершенств. Например, их сложно производить, поскольку терапевтические антитела требуют крупномасштабной культуры клеток млекопитающих и последующей строгой очистки в соответствии с надлежащей производственной практикой. Кроме того, антитела, разработанные на животных, должны быть специально подготовлены для введения в организм человека. К тому же они имеют короткий срок хранения, а модифицировать их чрезвычайно сложно. Терапевтические антитела достаточно большие и не проникают глубоко в ткани, известно, что только одно антитело из 100 достигает своей цели в организме, поэтому терапевтические дозы высоки и вызывают множество нежелательных реакций. Тогда ученые предложили альтернативу: заменить антитела искусственными аналогами аптамерами. Аптамеры — это небольшие одноцепочечные молекулы ДНК или РНК, их часто называют «синтетическими антителами». Они обладают высокой специфичностью к целевым клеткам, но, в отличие от антител, аптамеры просты в производстве, химическом синтезе и модификации. К тому же стоимость синтеза аптамеров в 1000 раз ниже, чем получение антител, а сами молекулы малоиммуногенны, малотоксичны и обладают небольшим размером, что обеспечивает лучшее проникновение в ткани и выведение из организма. А главное их преимущество – адресная доставка.
Красноярские ученые разработали аптамеры, специфичные к глиальным опухолевым клеткам, для нового контрастного агента и с помощью ранее разработанного метода уменьшили их размер с 60 до 47 нуклеотидов. Это позволит улучшить связывание молекулы с опухолевой клеткой-мишенью и уменьшить дальнейшую стоимость синтеза полученных аптамеров.
Для получения нового контрастного агента ученые оптимизировали их формулу разработанных аптамеров для большей специфичности и снабдили их инфракрасной меткой. Такой агент получил название IR-Glint. Он должен «прикрепляться» к клеткам опухоли мозга и подсвечивать их, обнаруживая границы опухоли.
Эксперименты, проведенные на лабораторных животных, подтвердили потенциал нового контрастного агента для визуализации глиом. Результаты показали высокую степень связывания агента с глиальными опухолевыми клетками и низкую – со здоровыми клетками. Высокая избирательность к опухолевым тканям и отсутствие фоновой флуоресценции обеспечивают контрастность и яркость изображения, что позволяет отличить опухолевые ткани от здоровых участков мозга. При этом препарат не оказывает острого токсического воздействия на организм мыши и может упростить процедуру резекции опухоли для хирурга.
Весомым преимуществом разработанной системы является вариативность его применения. Агент может использоваться как для внутривенного, так и для поверхностного внутричерепного применения, обеспечивая четкую визуализацию опухоли. При этом поверхностное применение непосредственно во время операции снижает требуемую дозировку лекарства, что смягчает потенциальное побочное воздействие на пациента и снижает затраты на производство. Препарат полностью выводится из организма в течение 24 часов.
«На сегодняшний день в мире до сих пор не было контрастного агента на основе аптамеров для интраоперационной визуализации глиомы, и, хотя аптамеры привлекательны для целевой терапии, они до сих пор не использовались для окрашивания опухолей. Мы впервые разработали такой контрастный агент на основе ДНК-аптамеров, названный IR-Glint. Он не оказывает токсического воздействия на мышей и быстро выводится. Другие наиболее широко используемые препараты в хирургической практике, в отличие от разработанного нами, неспецифически накапливаются в зоне отека и там, где повреждены сосуды, что может привести к ложноположительным и ложноотрицательным результатам. Это подчеркивают преимущество и потенциал нашего агента, который позволяет добиться заметной визуализации опухоли, что может значительно облегчить задачу хирурга при резекции опухоли мозга и открыть новые возможности в области нейрохирургии. Несомненно, исследования будут продолжены, углубляясь в свойства и механизмы действия IR-Glint с целью его дальнейшей интеграции в клиническую практику и обеспечения того, чтобы пациенты могли воспользоваться преимуществами научных знаний и достижений. Самое главное, что этот препарат заинтересовал Р-ФАРМ, и они консультировали нас на заключительных этапах разработки формулы патента и, будем надеяться, внедрят его в практику. Сейчас препарат проходит доклинические испытания», — рассказала Анна Кичкайло, доктор биологических наук, заведующая лабораторией цифровых управляемых лекарств и тераностики ФИЦ КНЦ СО РАН, руководитель лаборатории биомолекулярных и медицинских технологий Красноярского государственного медицинского университета им. проф. В.Ф. Войно-Ясенецкого.
В исследовании также принимали участие специалисты из ООО «Аптамеролаб» в рамках гранта «Сколоково», Дальневосточного федерального университета, ФГБУ «Федеральный Сибирский научно-клинический центр Федерального медико-биологического агентства», Томского государственного университета и Национального научного центра морской биологии имени А.В. Жирмунского. Материал подготовлен при поддержке гранта Минобрнауки России в рамках федерального проекта «Популяризация науки и технологий».
Информация и фото предоставлены службой научных коммуникаций ФИЦ «Красноярский научный центр СО РАН»
Автор фото: Анастасия Тамаровская / ФИЦ КНЦ СО РАН