Что такое опухоль? Чем она отличается от нормальных тканей? Какие существуют современные подходы в лечении рака? Почему с ним так трудно бороться? Правда ли, что опухолевые клетки бессмертны, и как им это удается? Об этом рассказывает Михаил Александрович Красильников, доктор биологических наук, профессор, директор Научно-исследовательского института канцерогенеза НМИЦ онкологии им. Н.Н. Блохина.
Михаил Александрович Красильников. Источник фото: пресс-служба НМИЦ онкологии им. Блохина
В Советском Союзе и сейчас в России онкологический центр им. Н.Н. Блохина ― единственное среди онкологических учреждений, где есть специализированный институт, занимающийся фундаментальными проблемами онкологии. Как правило, большинство онкологических учреждений в России в основном заняты клиническими разработками и тем, что связано с клиническими исследованиями. В ряде институтов и онкологических центров есть отдельные лаборатории, занимающиеся онкологией именно с точки зрения фундаментальных процессов, но так, чтобы все направления были сконцентрированы только в одном институте, ― случай единственный.
Институт канцерогенеза в структуре НМИЦ онкологии был организован в конце 1970-х гг. на базе экспериментального отдела Всесоюзного онкологического центра. Сейчас в институте 16 лабораторий, работающих практически по всем современным направлениям фундаментальной онкологии, начиная от проблем химического канцерогенеза, механизмов канцерогенеза, прогрессии опухолей, возможных подходов к терапии опухолей.
Что такое опухоль?
Исследования природы онкологических заболеваний стали активно развиваться только в начале ХХ в., до этого они рассматривались как второстепенные, сравнительно редкие заболевания, поскольку чаще встречались у пациентов пожилого возраста и относительно короткая продолжительность жизни ограничивала широкое распространение этой нозологии. Лишь потом, по мере увеличения продолжительности жизни, расширения знаний в области молекулярной биологии, стало понятно, что мы здесь сталкиваемся с абсолютно новым типом заболеваний.
В ХХ в. ученым удалось справиться со многими инфекционными заболеваниями, добиться значительного прогресса в лечении кардиопатий, ишемической болезни сердца и многих других, но онкологические заболевания по-прежнему стоят особняком. Ведь в основе злокачественного перерождения клеток лежат кардинальные нарушения генетического программирования нормальных тканей. Этот механизм сейчас активно изучается, и наши новые знания в данной области так или иначе претворяются в разработку новых подходов в лечении этого заболевания.
Исследования в онкологии шли параллельно с исследованиями в области фундаментальной биологии. Оказалось, что опухолевая клетка от нормальной клетки отличается принципиально: она в некотором смысле бессмертна. Все клетки организма, соматические клетки переживают определенное количество делений, после чего прекращают делиться, начинают стареть и умирать, но опухолевые клетки не стареют, они способны делиться бесконечное количество раз.
Когда был открыт феномен репликативного старения, стало понятно, почему стареют нормальные клетки и не стареют опухолевые. Было установлено, что в основе ограниченного деления нормальных клеток лежит постепенное сокращение длины хромосом ― процесс неизбежный, связанный с недорепликацией концевых участков хромосом в процессе митоза.
Теломерная теория
Так появилась теория, названная теломерной. Теломеры ― это концевые повторяющиеся последовательности хромосом, длина которых уменьшается при каждом цикле деления. Когда они сокращаются до недопустимого уровня, репликация прекращается, клетки перестают делиться и переходят в состояние репликативного старения.
М.А. Красильников: «Я считаю, что теломерная теория и подтверждение сокращения длины хромосомы в процессе репликации ― это одно из крупнейших открытий ХХ в. Этот процесс впервые был предсказан нашим ученым, профессором Алексеем Матвеевичем Оловниковым. Он опубликовал эту работу в 1960–1970-х гг. в отечественных журналах, которые были потом растиражированы. Теория А.М. Оловникова была признана и поддержана мировым сообществом. Позднее, после открытия и описания природы теломер была экспериментально показана справедливость его теории».
Однако, как выяснилось, в опухолевых клетках все иначе. Там активно синтезируется теломераза ― фермент, который наращивает теломеры. Благодаря активности этого фермента теломеры не сокращаются, и опухолевые клетки могут делиться бесконечное количество раз, что они и делают.
М.А. Красильников: «Например, в нашем НИИ мы поддерживаем культуры клеток, которые были выделены из первичных опухолей где-то в середине прошлого века, ― почти 100 лет прошло, но они живут и будут жить бесконечно долго. Это одно из фундаментальных свойств опухолевой клетки».
Космический монстр
Но, оказывается, в отношении онкологических заболеваний даже не это критично. Выясняется, что, помимо всего прочего, опухолевая клетка, как некий космический монстр, обладает невероятной способностью приспосабливаться. Она постоянно изменяется, развивая резистентность к лекарственным препаратам. Злокачественная клетка переключает свой метаболизм так, что уже не чувствует воздействия токсических соединений. На первом этапе терапии опухоль хорошо поддается лечению, но в дальнейшем формируются клоны опухолевых клеток, которые успели приспособиться к химиопрепаратам, стать устойчивыми к ним, и как результат возникает рецидив.
Это не значит, что наши врачи не могут лечить опухоль. В их арсенале много инструментов, но перед исследователями стоит задача сделать эти инструменты еще более эффективными и безопасными для здоровых клеток и всего организма в целом. А пока возможности вызвать точечную целевую гибель именно опухоли без воздействия на здоровые ткани нет.
Логично спросить: а как же таргетная терапия? Цель таргетной терапии — активно синтезирующиеся в опухолевых клетках белки, которые ответственны за формирование собственно опухолевого фенотипа. В основном это белки, участвующие в передаче ростового сигнала. Если на них воздействовать препаратом, который блокирует их активность, клетки перестают делиться ― это принцип действия таргетных препаратов.
Но эти белки могут, хоть и в меньшей концентрации, присутствовать и в нормальных клетках. Нет специфических белков, которые экспрессируются именно в опухолевых клетках. Ведь все белки опухолевых клеток ― это наши родные белки. Поэтому один из недостатков таргетной терапии ― сильный побочный эффект. И к таргетным препаратам, так же как и к химиопрепаратам, развивается резистентность ― по несколько иному механизму, но опухоль все равно довольно быстро приспосабливается.
Михаил Александрович Красильников. Источник фото: пресс-служба НМИЦ онкологии им. Блохина
Доставить препарат прямо к цели
Если говорить о современных перспективах терапии, то в нашей стране и в мире идут активные разработки специфической доставки препарата в опухоль. Это может обеспечить избирательное, точечное воздействие на опухолевые клетки. Хотя физическая доставка препарата только в опухоль и не снимает проблем резистентности, но, безусловно, увеличивает эффективность лечения. На данном этапе это очень серьезные и трудоемкие исследования: поиск способа доставки, подходящих материалов и структур, проблема иммунной атаки на подобные структуры и т.д.
Еще одно перспективное направление ― разработки по точечному воздействию на опухолевые клетки радиоактивными препаратами. В этом случае достигаются максимально эффективное воздействие на опухолевые клетки и минимизация побочного действия на окружающие ткани. Хотя и при этом методе остается проблема резистентности: при длительных повторяющихся сеансах радиотерапии могут возникнуть клоны опухолевых клеток, малочувствительные к облучению.
Отдельный разговор ― вакцины от рака. У опухоли, как правило, есть механизм, который предотвращает иммунную атаку, а задача исследователей ― подобрать путь активизации иммунной системы, чтобы она начала интенсивнее бороться с опухолью. Сегодня это одно из активно развивающихся направлений противоопухолевой терапии. Во многих случаях удается достигнуть хорошего клинического эффекта. Такие вакцины создают и в НМИЦ онкологии им. Н.Н. Блохина.
Но и здесь есть ряд задач, которые ученым нужно решить: во-первых, не все опухоли чувствительны к иммунотерапии, во-вторых, эффект иммунотерапии часто оказывается преходящим, в том числе и за счет постепенного развития устойчивости опухолей к иммунной атаке.
Не допустить метастазирования
Помимо повышенной резистентности, способности к иммортализации, бессмертию, одно из ключевых свойств опухолевой клетки, которое может привести к гибели организма, ― метастазирование, образование вторичных очагов опухолевого роста. Если нам удастся локализовать опухоль, предотвратить образование метастазов, это будет важнейший шаг на пути к победе. И это огромный пласт современных научно-исследовательских работ.
Как опухоль попадает в кровоток и начинает распространяться по организму? Оказалось, в основе лежит эпителиально-мезенхимальный переход опухолевых клеток. Этот процесс был установлен сравнительно недавно, и именно он обеспечивает определенную свободу миграции опухолевой клетке.
А вот клетки в обычных соматических тканях никуда не мигрируют. В основном это результат контактного торможения: когда клетки растут вместе, они формируют единый конгломерат, ограничивающий клеточную подвижность. Эффект контактного торможения резко снижается в опухолевых клетках, претерпевших эпителиально-мезенхимальный переход, благодаря которому клетка в результате кардинальных изменений, в первую очередь структуры цитоскелета, приобретает способность к инвазии и метастазированию.
М.А. Красильников: «В нашем институте есть целое направление по изучению механизма возникновения подобной подвижности: как и почему клетка получает возможность перемещаться по всему организму, инвазировать в стенку сосуда, достигать кровотока и оседать в определенных местах. Для конкретных видов опухолей есть локализации, где чаще всего идет метастазирование. Почему клетка выбирает именно это место? Это активно развивающееся направление исследований».
Почтальон звонит дважды
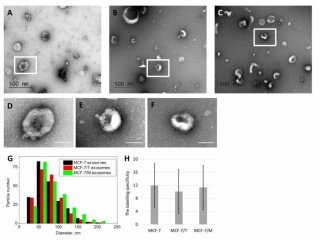
Опухоль, помимо всего прочего, умеет отправлять «посылки», как почтальон. Речь идет об экзосомах ― это микровезикулы, которые были открыты в 80-х гг. прошлого века. Это мельчайшие образования, содержащие часть клеточной цитоплазмы, которые клетка секретирует наружу. Оказалось, что опухолевые клетки обладают точно такой же способностью формировать и выводить микровезикулы. Но главное, что потом и определило взрыв интереса к экзосомам, ― они содержат массу всего полезного с точки зрения клетки. Это белки, микро-РНК, фрагменты РНК и ДНК, разнообразные липиды, биологически активные соединения и т.д. Они секретируются клеткой в составе экзосом и могут переносить биомолекулы, участвующие в формировании лекарственной резистентности, от опухолевой клетки в окружающие клетки. Тогда резистентность к противоопухолевому лечению развивается максимально быстро.
Стало понятно, что ткань, окружающая опухоль, ― уже не совсем нормальная ткань, как думали раньше. Под воздействием растущей опухоли в ней происходят процессы, которые сильнейшим образом репрограммируют эти клетки, и они приобретают способность поддерживать рост самой опухоли. А это уже может быть использовано в качестве нового подхода к противоопухолевой терапии: воздействовать не только на саму опухоль, но и на окружающую ткань, чтобы она перестала поддерживать рост опухоли.
В онкологии также важны такие понятия, как генетические и эпигенетические мутации. Генетические ― это нарушение структуры ДНК: замена одного нуклеотида, амплификация, делеция. Когда меняется структура гена, нарушается и его экспрессия: белок, который кодируется этим геном, может не синтезироваться или отличаться пониженной активностью.
В случае эпигенетических модификаций перемены в экспрессии генов не связаны с нарушениями последовательности ДНК. Причиной может стать изменение структуры самих нуклеотидов либо изменение на уровне регуляторных факторов, которые могут подавлять или активировать экспрессию определенных генов.
Что касается модификаций нуклетотидов, здесь на первый план выходит метилирование ДНК ― один из основных эпигенетических механизмов, регулирующих эеспрессию генов. Из других эпигенетических факторов необходимо отметить микро-РНК ― сравнительно недавно описанный новый класс некодирующих РНК. Микро-РНК обладают мощной биологической активностью и регулируют экспрессию генов, взаимодействуя с матричной РНК, блокируя ее активность.
РНК, образующие кольца
Сегодня это одно из интереснейших направлений научных исследований: описаны десятки микро-РНК, которые регулируют экспрессию тех или иных белков, в том числе ассоциированных с опухолевым ростом. Их можно в перспективе использовать в терапии.
Недавно были обнаружены кольцевые РНК ― структуры, напоминающие микро-РНК в форме кольца. Оказалось, что они, как губка, всасывают в себя микро-РНК: если микро-РНК гиперэкспрессирована, то они блокируют и снижают ее активность. Более того, в отличие от микро-РНК некоторые из кольцевых РНК могут служить матрицей для синтеза белков ― коротких пептидов с пока непонятной биологической активностью, ведь исследования на эту тему только начинаются.
М.А. Красильников: «Меня часто спрашивают: можно ли победить рак? Суть этого вопроса схожа с темой репликативного старения. Долгое время шли дискуссии, почему же клетка стареет, пока не стало понятно, что это процесс необратимый, связанный с неизбежным сокращением длины теломер во время клеточного деления. Но геном подвижен и подвержен постоянному мутационному давлению, которое может привести и к канцерогенезу. Клетка по мере циклов деления либо входит в состояние репликативного старения, когда теломеры укорачиваются, либо уходит в сторону опухолевой трансформации. На мой взгляд, это два базовых варианта старения и гибели организма: с одной стороны, классическое репликативное старение, с другой ― опухолевая трансформация».
В отличие от инфекционных и других заболеваний в случае злокачественного перерождения мы сталкиваемся с кардинальными изменениями функционирования клетки. Затронуты абсолютно интимные процессы, которые регулируют жизнедеятельность клетки.
Когда старость в радость
Нередки случаи, когда опухоль, особенно на поздних стадиях заболевания, нельзя полностью ликвидировать. Но можно ли научиться поддерживать ее в таком состоянии, чтобы она нас не убивала и не мешала нам жить? Этот вопрос представляется более перспективным. И ответ на него положительный.
Но как это сделать? Мы уже поняли, что опухолевые клетки не стареют. А можно ли вызвать у них старение искусственно?
Оказалось, что да. Под действием облучения или химиопрепаратов клетка оказывается в особом состоянии, когда активируются сигнальные пути, которые не позволяют ей делиться. Опухолевая клетка в таком виде застывает, приобретая фенотип стареющих клеток. Идея зафиксировать их в таком состоянии индуцированного старения ― это один из перспективных подходов исследований в области химиотерапии. Тут два варианта: либо заморозить, зафиксировать их долговременно, либо разработать препараты, которые будут целенаправленно убивать эти покоящиеся клетки. Оба направления активно развиваются.
Снизить ущерб от развития опухоли в организме, привести ее в контролируемое состояние ― важные для нас задачи. С каждым новым открытием мы все глубже понимаем процесс опухолевой трансформации, и это не только расширяет горизонт научного познания, но и открывает новые перспективы диагностики и лечения злокачественных новообразований.
Статья подготовлена при поддержке Министерства науки и высшего образования РФ
Автор фото на слайде: Арег Гукасян