Фотография северной наваги (лат. Eleginus nawaga). Источник: Анна Жадан, Беломорская биостанция МГУ
Международный коллектив исследователей под руководством Дениса Абрамочкина, ведущего научного сотрудника кафедры физиологии человека и животных биологического факультета МГУ, выяснил, как фенантрен — один из компонентов нефти и дизельного топлива — влияет на работу сердца рыб. В экспериментах на беломорской биостанции МГУ учёные выявили механизм действия фенантрена на электрическую активность миокарда рыб на примере арктической рыбы наваги. Наблюдаемый кардиотоксический эффект фенантрена может привести к развитию нарушений ритма рыбьего сердца вплоть до его остановки. Исследование поможет найти новые способы по уменьшению негативных последствий разливов нефти. Результаты опубликованы в престижном журнале AquaticToxicology (Q1 в базах WoS и Scopus). Работа выполнена в рамках деятельности научно-образовательной школы МГУ «Молекулярные технологии живых систем и синтетическая биология».
В последние годы человечество приступило к активному освоению нефтегазовых ресурсов Арктики. Для работы в суровых условиях Севера применяются самые совершенные и экологически безопасные технологии, тем не менее полностью исключить вероятность техногенных аварий в арктическом поясе нельзя. К примеру, в 1989 году в результате крушения танкера Эксон Валдис у берегов Аляски более 35 тысяч тонн нефти попало в океан. Нефтепродукты негативно влияют на разные органы и системы живых организмов, однако механизмы этого воздействия изучены недостаточно подробно.
Коллектив учёных из России и Великобритании под руководством сотрудника биологического факультета МГУ выяснил, как воздействует фенантрен — полициклическое ароматическое соединение, один из компонентов нефти и нефтепродуктов — на сердце рыб. В качестве модельного объекта была выбрана распространенная в арктических морях тресковая рыба северная навага (лат. Eleginus nawaga).
«Полициклические ароматические углеводороды являются одним из основных компонентов нефти, и в предыдущих работах была показана их способность вызвать нарушения нереста рыб, разнообразные аномалии развития, приводящие к гибели икринок или появлению нежизнеспособных мальков, — рассказывает главный автор исследования, ведущий научный сотрудник биологического факультета МГУ Денис Абрамочкин. — Значительно хуже изучено действие таких соединений на взрослых рыб, в частности на их сердечно-сосудистую систему».
Исследование проходило на Беломорской биологической станции имени Н.А. Перцова биологического факультета МГУ. Биостанция расположена на берегу Кандалакшского залива Белого моря, где не было масштабных загрязнений акватории нефтепродуктами, а значит, местная навага не подвергалась их воздействию. Эксперименты проходили на отдельных клетках сердца, кардиомиоцитах, полученных путем обработки сердец наваги ферментами, разрушающими соединительную ткань.
Электрическая активность сердца и отдельных кардиомиоцитов критически важна для их работы. Без электрического возбуждения кардиомиоцита нет и его сокращения. В покое мембрана кардиомиоцита имеет с внутренней стороны негативный электрический заряд. Возбуждение клетки представляет собой резкую перезарядку мембраны – в течение нескольких миллисекунд она приобретает положительный заряд, этот процесс называется деполяризацией. Затем в течение уже сотен миллисекунд происходит постепенная реполяризация – мембранный потенциал возвращается к исходным негативным значениям.
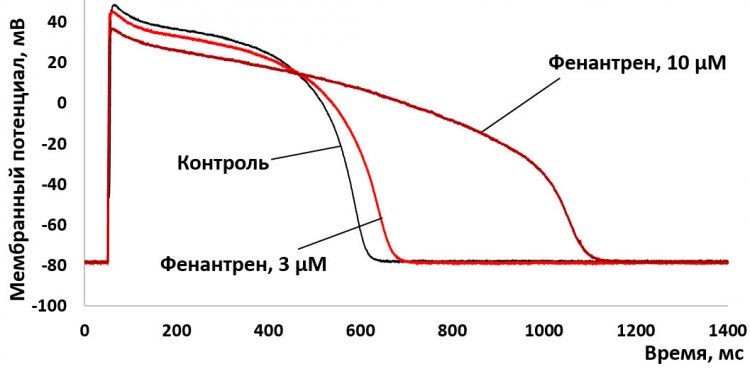
Изменение формы потенциала действия в желудочковом кардиомиоците наваги под действием микромолярных концентраций фенантрена. Источник: Денис Абрамочкин, МГУ
Комплекс из деполяризации и реполяризации физиологи называют потенциалом действия. От конфигурации потенциала действия в отдельных кардиомиоцитах зависят свойства электрической активности целого сердца. В свою очередь его конфигурация определяется токами ионов через несколько видов особых мембранных белков, ионных каналов. С использованием техники пэтч-кламп, позволяющей регистрировать отдельные виды ионных токов в кардиомиоцитах, исследователи выяснили, как каждый из них изменяется под действием микромолярных концентраций фенантрена и как при этом видоизменяется форма потенциала действия. Оказалось, что основной мишенью для фенантрена являются каналы ERG, переносящие быстрый калиевый ток задержанного выпрямления IKr, основной ток, отвечающий в сердцах рыб за процесс реполяризации. Блокируя этот ток в концентрациях от 1 до 10 мкМ, фенантрен вызывает удлинение потенциала действия (см. рисунок).
«Надо сказать, что избыточное удлинение потенциала действия в кардиомиоцитах желудочков сердца способствует возникновению желудочковых аритмий, которые могут привести к остановке сердца. В нашем сердце есть «страховочные механизмы», другие калиевые токи задержанного выпрямления, позволяющие не допустить такого развития событий даже в случае существенного подавления IKr . А вот у рыб такой страховки нет, поэтому для их сердца фенантрен очень опасен как потенциальный индуктор аритмий, — поясняет Денис Абрамочкин. — Существенное воздействие на кардиомиоциты фенантрен оказывал даже в концентрации 1 μМ, в то время как в кровяном русле людей были зарегистрированы и втрое превышающие это значение его концентрации».
Итак, механизм электрофизиологических эффектов фенантрена в рыбьем сердце теперь ясен. Также определены концентрации этого соединения, опасные для наваги, одной из промысловых морских рыб нашего Севера. Эти знания позволят лучше оценить потенциальное влияние разливов нефти на биоресурсы Арктики и предложить новые способы по уменьшению их негативных последствий.
В работе принимали участие сотрудники Манчестерского университета (Великобритания).
Информация и фото предоставлены пресс-службой МГУ