В последние два десятилетия во всем мире активно развиваются работы в области клеточных и геномных технологий. Их продолжают считать революцией в биологии и медицине и новым вызовом цивилизации. Открытие стволовых клеток вызвало небывалый ажиотаж, их стали называть «эликсиром молодости» и панацеей от множества болезней. Однако почти сразу стали очевидны и важнейшие ограничения применения эмбриональных стволовых клеток в клинической практике. О современном этапе развития клеточных технологий и проектах Института биомедицинской химии им. В.Н. Ореховича рассказывает член-корреспондент РАН Константин Ярыгин.
Константин Никитич Ярыгин — доктор биологических наук, член-корреспондент РАН, заведующий лабораторией клеточной биологии Института биомедицинской химии им. В.Н. Ореховича.
— В свое время работы в области клеточных технологий называли революцией и новым вызовом в биологии и медицине. Почему их считали и продолжают считать таковыми?
— Клеточные технологии — это раздел биомедицины, возникший на основе достижений фундаментальных наук, прежде всего гистологии, цитологии, клеточной биологии и молекулярной биологии. Принципиальную роль в их развитии сыграло открытие стволовых клеток, и наши соотечественники были здесь первыми. Так, еще до Октябрьской революции А.А. Максимов, который работал в Императорской военно-медицинской академии, открыл гемопоэтические стволовые клетки. А в 70–80-е гг. ХХ в. А.Я. Фриденштейн охарактеризовал мезенхимальные стволовые клетки.
Огромный интерес к стволовым клеткам возник, когда были обнаружены эмбриональные стволовые клетки. В 1981 г. их выделили из бластоцист (ранних эмбрионов) мышей, а в 1998 г. — из бластоцист человека. После этого во всем мире начался медийный ажиотаж. Люди верили, что это открытие очень быстро позволит выращивать органы для трансплантации, обновлять поврежденные ткани. Но ничем не омраченная радость длилась недолго.
Первым препятствием стал не научный аспект, а этический. Ведь для получения эмбриональных клеток необходимо использовать бластоцисту, эмбрион на ранней стадии, что вызывало вопросы о легальности данной процедуры. Например, каков гражданско-правовой статус человеческой бластоцисты, можно ли с ней свободно обращаться, кто решает ее участь — родители или кто-то еще, например врач, в случае ее получения в результате ЭКО? Окончательных ответов на эти вопросы до сих пор нет.
Помимо этических проблем возникли проблемы научные, поскольку управлять «судьбой» культуры эмбриональных стволовых клеток оказалось не так легко. При трансплантации эмбриональных клеток в живой организм образуются тератомы, опухоли, состоящие из смеси клеток, дифференцирующихся в самых разных направлениях.
Научное сообщество постепенно училось обращаться с эмбриональными стволовыми клетками. Сегодня их дифференцировку можно направить в любую нужную сторону и получить нейроны, мышечные волокна, гепатоциты, стромальные клетки, клетки крови, даже герминативные клетки – предшественники яйцеклеток и сперматозоидов. Большинство читателей наверняка знают об индуцированных плюрипотентных клетках. Они очень похожи на эмбриональные клетки, но их можно получать из любых клеток уже взрослого организма. Правда, следы той дифференцировки, которую они на протяжении жизни проходили, все же остаются.
Параллельно велись исследования гемопоэтических стволовых клеток, развивались технологии трансплантации костного мозга, сыгравшие огромную роль в лечении лейкозов, особенно детских, развивались технологии работы с мезенхимальными стволовыми клетками, первоначально обнаруженные А.Я. Фриденштейном. Он определял их как клетки поддерживающие, создающие нишу для гемопоэтических клеток. Впоследствии оказалось, что мезенхимальные стволовые клетки имеют огромное количество полезных свойств. Сегодня они успешно испытаны на животных моделях для лечения разнообразных заболеваний путем клеточной терапии, то есть путем введения клеток в организм. Мезенхимальные стволовые клетки и индуцированные плюрипотентные клетки используются для создания фрагментов тканей и органов in vitro. Некоторые подобные фрагменты трансплантировались в организм человека и хорошо приживались. В целом область клеточных технологий продолжает развиваться очень динамично.
— Что сегодня входит в понятие «клеточные технологии»? На стыке каких наук они развиваются?
— Формально клеточные технологии включают в себя любые решения, основанные на использовании живых клеток. Как ни странно, самая активно внедряемая клеточная технология не имеет отношения к стволовым клеткам, о которых мы говорили выше. Это CAR-T-клеточная терапия, используемая для лечения различных онкозаболеваний. Речь идет о создании Т-лимфоцитов определенной специфичности, атакующих раковые клетки. Больше сотни подобных технологий проходят сегодня клинические испытания. Одну из них испытывают и в нашей стране. Кроме того, разрабатывается похожая технология, но с использованием не Т-лимфоцитов, а других иммунных клеток — натуральных киллеров. В практическом плане это наиболее активно развивающаяся область.
Если говорить о практическом использовании стволовых клеток, то их культуры широко применяются для тестирования лекарств и исследования индивидуальных особенностей людей, в частности особенностей их реакции на лекарства, что вносит вклад в развитие такого перспективного направления, как персонифицированная медицина. Во всем мире проводятся тысячи исследований по клиническому использованию клеточной терапии и тканевой инженерии, хотя к широкому использованию разрешены пока лишь несколько основанных на стволовых клетках биомедицинских продуктов и методик.
— Это направление находится на стыке и биологии, и химии, и генетики. Верно?
— Да, конечно. Эти исследования требуют участия большого количества специалистов разных профилей. По этой же причине они довольно дорогие.
— Вы упомянули, что клетки постепенно утрачивают свою универсальность, становятся дифференцированными для выполнения конкретных функций в нашем организме. Можно ли предсказать, какой клетка станет в будущем?
— Да, конечно. Это зависит от условий, в которых она находится. Оплодотворенная яйцеклетка постепенно дробится на какое-то количество бластомеров. Последние в свою очередь начинают дифференцироваться, и из них получаются разные клетки: оболочки зародыша и сам зародыш. По мере развития определенные части зародыша дифференцируются, естественно, по-разному. При этом некоторые клетки на протяжении всей жизни остаются в недифференцированном состоянии. Эти клетки называются региональными стволовыми клетками, за счет которых в значительной степени обновляется большинство органов. Региональные стволовые клетки малодифференцированные. Они не выполняют никаких функций, а просто ждут своего часа, чтобы обновить работающие клетки тканей и органов.
Дифференцировка клетки происходит за счет активации одних участков ее генома и блокирования других. Долгое время, вплоть до конца XX в., считалось, что дифференцировка необратима. Скажем, фибробласт — клетка соединительной ткани — какое-то время остается фибробластом, а потом погибает. Она никогда не сможет измениться и стать мышечным волокном или нейроном. Но оказалось, что это не так и дифференцировку можно обратить.
Искусственно введя в дифференцированную клетку гены, активно экспрессирующиеся на эмбриональной стадии развития, мы можем получить клетку, очень похожую на эмбриональную стволовую клетку, из которой затем можно получить любую другую клетку. Частичную дедифференцировку, то есть развитие в обратном направлении, можно получить без изменения генетического аппарата, используя специальный «коктейль» из белков и малых молекул. Например, гепатоциты можно дедифференцировать и превратить в активно размножающиеся, похожие на фибробласты клетки. Этот процесс обратим, и полученные клетки можно редифференцировать в гепатоциты.
В ИБМХ разрабатываются подходы к созданию эффективных методов клеточной иммунотерапии онкологических, хронических вирусных и аутоиммунных заболеваний. Подходы включают в себя направленную модификацию клеточных популяций, включая редактирование генома
Фенотип клетки, то есть то, к какому клеточному типу (эпителий, мышца, нейрон и т.д.) она принадлежит, определяется ее эпигеномом, то есть тем, какие участки цепи ДНК в ней метилированы и каково расположение в составе хромосом и степень ацетилирования ядерных белков гистонов. В процессе развития организма возникает характерный паттерн метилирования ДНК и ацетилирования гистонов, определяющий, какие гены активны, а какие «молчат». С возрастом регуляция работы генетического аппарата клетки нарушается и некоторые участки ДНК, которые в клетке данного фенотипа должны быть закрыты, открываются, соответствующие гены активируются. С этим связано большинство хронических заболеваний пожилых людей. Процесс разбалансировки эпигенома можно обратить вспять путем введения в клетку извне набора эмбриональных генов.
— Шаг к персонализированной медицине?
— Шаг к омоложению.
— О котором многие мечтают.
— Совершенно верно.
— Когда говорят о блокировке генов, часто упоминают японского профессора, нобелевского лауреата Синъю Яманаку.
— Профессор Яманака знаменит тем, что он, собственно говоря, и получил индуцированные плюрипотентные клетки — сначала из клеток мыши, потом из человеческих клеток. В 2013 г. ему за это присудили Нобелевскую премию. Надо сказать, что его работу в Японии серьезно поддержали на правительственном уровне. После открытия был создан целый институт, сотрудники которого пытаются приспособить эту технологию для практических целей медицины: персонализированного тестирования лекарственных препаратов, создания моделей клеточных болезней и, наконец, для терапевтических целей. Последнее пока не реализовано. Попытка лечить дегенерацию сетчатки привела к ряду неприемлемых побочных эффектов, что стало вызовом для японских коллег.
— Продолжая разговор о безопасности этих технологий, хочется подробнее узнать об остаточных явлениях, которые могут повлиять на организм человека. Насколько мне известно, подобную ситуацию называют хоумингом. Приблизилось ли научное сообщество к решению этой проблемы?
— На самом деле хоуминг — это широкое понятие, характеризующее внедрение клеток в любую ткань. Например, если клетка крови или введенная искусственно в кровоток стволовая клетка прикрепляется к стенке сосуда, а затем проникает в ткань, это хоуминг. Проблемы теоретически могут возникнуть, если клетки, подвергшиеся хоумингу в какой-то ткани, начинают там себя «плохо вести». Например, на заре развития клеточных технологий были сообщения о том, что введенные в кровоток фибробласты могут проникать в ткани и вызывать их фиброз. Впрочем, в большинстве последующих исследований эти данные не подтвердились.
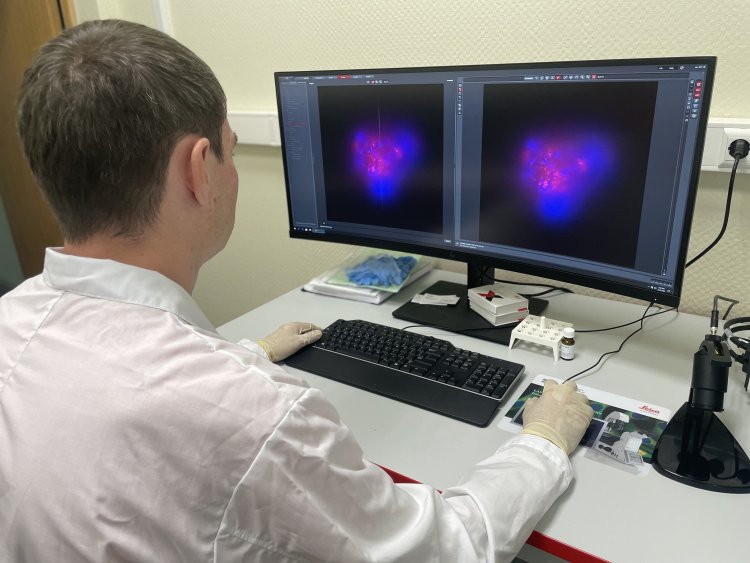
Ученые из ИБМХ проводят разносторонние исследования, направленные на изучение свойств мезенхимальных стволовых клеток, а также разрабатывают подходы к их практическому использованию в регенеративной медицине
Но есть опасности иного рода, связанные с развитием онкологических заболеваний. Конечно, все сильно зависит от используемых технологий.
В клеточной терапии, например, в основном используются мезенхимальные стволовые клетки. В практике встречались сообщения о том, что они могут вызывать опухоли, но подобных сообщений, во-первых, очень мало, во-вторых, в подавляющем большинстве доведенных до конца клинических исследованиях подтверждена безопасность мезенхимальных стволовых клеток. Другое дело, что довольно редко мы видим высокую эффективность этой методики. Некоторые клетки бывают очень эффективны при исследовании на животных моделях и совсем не эффективны при использовании в клинике. И, я думаю, тут вопрос к организации клинических исследований и к отбору пациентов для тестирования.
— А с чем еще может быть связана такая низкая эффективность?
— Человек — это не животное, и регенеративные способности наших тканей невелики по сравнению со многими другими видами. Если вы отрубите ящерице хвост, он вырастет. И у многих животных части тела и конечности регенерируют, а у нас нет. Кроме того, в экспериментах обычно используют молодых животных, а лечат чаще пожилых людей. Тем не менее в ряде клинических исследований терапия стволовыми клетками оказалась очень эффективной.
— Предпринимаются ли в контексте регенеративной медицины попытки улучшения восстановления человеческих тканей?
— Конечно, подобные исследования ведутся, но пока не имеют реального клинического воплощения. Некоторые сводятся к исследованию эмбриогенеза, индивидуального развития человека. Ученые ищут закономерности, которые указывали бы на то, почему мы утратили способность к полной регенерации частей тела и органов и как с этим бороться.
— Как направление регенеративной медицины представлено в Институте биомедицинской химии?
— Это направление мы реализуем совместно с отделом медицинских нанобиотехнологий медико-биологического факультета РНИМУ им. Н.И. Пирогова. Отдел возглавляет вице-президент РАН В.П. Чехонин. Мы исследуем возможности клеточной терапии ишемического инсульта. Эти исследования в свое время были начаты по инициативе бывшего ректора РНИМУ В.Н. Ярыгина, моего старшего брата, и В.И. Скворцовой, которая сегодня возглавляет Федеральное медико-биологическое агентство. Эти работы ведутся достаточно успешно. Скоро мы перейдем на крупных животных, а затем, если все пройдет успешно, будем добиваться разрешения на клинические исследования. Приятно, что в проект вовлечены молодые сотрудники. Ведь процесс создания новых методов лечения сильно растянут во времени.
— А какие еще направления развиваются в вашей лаборатории клеточной биологии?
— Наш институт традиционно развивал два основных направления: протеомику, которая изучает репертуар белков, присутствующих в живом организме, и биоинформатику. В последнее время кроме протеомики продвигаются и другие омиксные технологии. Прежде всего, это транскриптомика, в рамках которой исследуется репертуар РНК, транскрибируемой на геноме в разных клетках. Проводятся также исследования в области метаболомики, посвященные метаболизму клеток и целого организма. В рамках интерактомики исследуется, какие макромолекулы — белки, полисахариды, липиды, нуклеиновые кислоты — специфически взаимодействуют друг с другом и как это влияет на регуляторные процессы, которые происходят в организме. Помимо этого, институт участвует в международном проекте «Протеом человека». Цель российской части проекта — определение протеома 18-й хромосомы человека.
В нашей лаборатории создана группа, которая занимается раковыми стволовыми клетками, ответственными за инициацию опухоли. По-видимому, во многих случаях именно они обеспечивают метастазирование и рецидив после удаления опухоли. Мы исследуем в основном клетки рака толстого кишечника — как регулируется метаболизм этих клеток, как они перемещаются, чем на них можно воздействовать. Кроме того, мы изучаем еще стромальные клетки колоректального рака. Раковая опухоль состоит не только из раковых клеток. Ее каркас (строма) формируется фибробластами соединительной ткани. Клетки опухолевой стромы сильно отличаются от клеток стромы здоровых тканей прежде всего тем, что они подавляют активность иммунных клеток, не позволяя им разрушать опухоль.
— С чем это может быть связано?
— Есть предположение, связанное с работой дендритных клеток. В организме есть дендритные клетки, которые захватывают чужеродный белок, разбивают его на составные части и обучают лимфоциты узнавать их и либо вырабатывать против них антитела, если это В-лимфоцит, либо убивать несущую этот белок клетку, если это Т-лимфоцит.
За счет выработки целой группы интерлейкинов и других регуляторных молекул клетки опухолевой стромы подавляют иммунитет, не давая моноцитам дифференцироваться в дендритные клетки. Кроме того, подавляются еще и сами Т-лимфоциты, которые убивают опухолевые клетки.
— То есть раковая клетка получает механизмы защиты, обхода от иммунитета?
— На самом деле у раковой опухоли очень много механизмов защиты. Сегодня рак во многих случаях уже не приговор, но тем не менее это очень коварная болезнь.
— Вы рассказали о множестве разных направлений, которые, как мне кажется, должны заинтересовать молодое поколение ученых. Приходят ли к вам молодые ученые?
— Конечно, к нам приходит много студентов, начиная с третьего курса. Раньше это были в основном студенты из второго мединститута — РНИМУ им. Н.И. Пирогова, поскольку мы читаем лекции, преподаем на кафедрах биохимии и биологии. Но в последнее время приходит все больше студентов из первого мединститута — Сеченовского университета. Это очень удобно, поскольку здания находятся близко друг к другу, фактически через дорогу. Так что с молодыми кадрами проблем нет.
— Расскажите о себе, как вы сами стали заниматься клеточными технологиями, чем вас привлекла эта область?
— В 2002 г. я получил предложение, от которого было трудно отказаться.
— И вы уже 20 лет работаете в ИБМХ?
— Да, более 20 лет. До этого я занимался совсем другим. Я работал в кардиологическом центре, который организовал академик Е.И. Чазов, недавно почивший, к сожалению. Институт экспериментальной кардиологии (ныне НМИЦ кардиологии им. академика Е.И. Чазова) тогда возглавлял В.Н. Смирнов, человек тоже выдающийся во всех отношениях.
Мы пытались изолировать биологически активные пептиды из таких органов, как эпифиз, гипофиз и гипоталамус. Это были очень интересные работы. Постепенно мы сосредоточились на опиоидных пептидах, сделали лекарство, которое до сих пор используется в медицинской практике.
Поскольку я всю жизнь занимался клеточной биологией, то могу сказать, что в те годы это было довольно тяжелое занятие. Работа в современной клеточной лаборатории отличается от той, что была 20 лет назад, как «Мерседес» от старых «Жигулей», даже больше.
— Процесс упрощает новая техника?
— В том числе. Главное — то, что оборудование позволяет автоматически обеспечивать необходимый уровень стерильности. С другой стороны, многие жалуются на то, что стало скучно. Становится меньше задач, требующих мастерства, так сказать, ловкости рук.
— Но ведь есть еще столько нерешенных вопросов.
— Сегодня результат уже меньше зависит от приобретенных в университете навыков. Приходится больше думать и постоянно учиться.
— В чем вы видите перспективы развития клеточных технологий в дальнейшем? На какие направления стоит обратить внимание тем, кто только начинает этот путь?
— На этот вопрос очень трудно ответить. Как мне кажется, в ближайшие годы будет активно развиваться направление, связанное со стимулированием регенерации in situ в организме без извлечения клеток и работы с ними вне организма. Но большое внимание будут уделять и способам создания органов вне организма для трансплантации. Пусть сейчас это звучит как фантастика, но вполне вероятно, что будут использоваться сложные биоинженерные конструкции, состоящие из живых тканей и каких-то неживых частей, например микроплат или механических конструкций, а также гуманизированные, то есть узнаваемые как свои иммунной системой человека ксеногенные органы, то есть органы животных, вероятнее всего свиньи.
Уже сейчас существует много приложений, которые используются в научных исследованиях: клеточные модели заболеваний, клетки для исследования различных процессов и методов ингибирования или стимулирования этих процессов, например ангиогенеза, то есть образования новых сосудов, прежде всего в опухолях. Сегодня все это активно изучается in vitro и, возможно, совсем скоро будет повсеместно применяться на практике. Так что работы на всех хватит.
Интервью проведено при поддержке Министерства науки и высшего образования РФ и Российской академии наук.