Когда мы говорим о редких химических элементах, то невольно представляем себе драгоценные металлы. Однако, например, золото или платина, хоть и редко, но встречаются в виде самостоятельных минералов. А вот по-настоящему редкими можно считать элементы, которые растворены в других минералах и их очень трудно выделить. Как правило, такие устойчивые соединения образуют близкие по составу элементы, и чем больше сходство, тем сложнее найти такую химическую реакцию, которой можно было бы извлечь их в чистом виде. Однако затраты на производство себя окупают — область применения редких веществ очень обширна, а их уникальные свойства будоражат научное сообщество и заставляют ученых биться в попытках искусственно воссоздать хотя бы частичку, чтобы наконец изучить загадочную материю.
Редкие металлы
Существуют разные научные подходы к изучению редких химических веществ. Поэтому перечень у разных авторов незначительно расходится. Но, как правило, под «редкими элементами» подразумеваются группы рассеянных, легких, тугоплавких, радиоактивных и редкоземельных элементов. Многие могут быть отнесены одновременно к разным группам.
Солнечные батареи из фосфида и арсенида галлия по сравнению с кремниевыми элементами служат дольше, более эффективно передают энергию и менее чувствительны к высоким температурам.
Фото: senivpetro / фотобанк Freepik
Группа рассеянных объединяет такие элементы, как индий (In), галлий (Ga), германий (Ge), таллий (Tl) и рений (Re), а также селен (Se) и теллур (Te). Они не встречаются в природе в виде самостоятельных минералов и залежей, а только извлекаются из руд других металлов и полезных ископаемых, к которым они близки по свойствам. Например, галий содержится в алюминиевых минералах, германий встречается в каменных углях, индий, таллий и германий — в сфалерите. Получается, что они буквально рассеяны в виде примесей, которые «прячутся» в чужих минералах.
Важнейшая область освоения рассеянных элементов — полупроводниковая техника. Галлий используется в солнечной энергетике — солнечные батареи из фосфида и арсенида галлия по сравнению с кремниевыми элементами служат дольше, более эффективно передают энергию и менее чувствительны к высоким температурам.
Уран, плутоний и торий применяются в качестве топлива для атомных реакторов.
Фото: jplenio1 / фотобанк Freepik
В группу легких редких элементов включают литий (Li), рубидий (Rb), цезий (Cs) и бериллий (Be). По названиям можно догадаться, что они отличаются малой плотностью — меньше 2 г/см3. Для сравнения, плотность твердого германия — 5,327 г/см³, а теллура — 6,24 г/см³. К тому же легкие элементы обладают высокой химической активностью, поэтому, например, литий используют в качестве теплоносителя в ядерных реакторах, а бериллий — в авиа- и ракетостроении как конструкционный материал и электронику. Легкие редкие металлы получают электролизом расплавов солей (выделение вещества под действием постоянного тока) или металлотермическим способом (при повышенных температурах).
В радиоактивную группу входят радий (Ra), торий (Th), уран (U) и плутоний (Pu). Уран, плутоний и торий служат источниками ядерной энергии. Применяются в качестве топлива для атомных реакторов и атомного оружия. Они также получаются искусственным путем полураспада, химические элементы крайне радиоактивны и ядовиты для человека. К примеру, около пятимиллионных долей грамма реакторного плутония, попавших в легкие, способны вызвать рак.
Одна из многочисленных областей применения редкоземельных элементов — изготовление лазерной техники.
Фото: freepik / фотобанк Freepik
В редкоземельную группу входят 15 близких по своим свойствам элементов. Как можно понять по названию, они редко встречаются в земной коре и делятся на две подгруппы: цериевую — лантан (La), церий (Ce), празеодим (Pr), неодим (Nd), прометий (Pm), самарий (Sm) и иттриевую — европий (Eu), гадолиний (Gd), тербий (Tb), диспрозий (Dy), гольмий (Ho), эрбий (Er), тулий (Tm), иттербий(Yb), лютеций (Lu), скандий (Sc) и иттрий (Y). Редкоземельные элементы — металлы серебристо-белого цвета, их получают восстановлением соответствующих оксидов, фторидов, электролизом безводных солей и другими методами.
Редкоземельные элементы применяют в различных отраслях: черной и цветной металлургии, производстве стекла (лантан, церий, неодим и прометий повышают светопрозрачность стекла) и керамики, атомной, электроосветительной, телевизионной и лазерной технике, химической промышленности, медицине, сельском хозяйстве. По мере изучения свойств семейства «Лантаноидов» возможности их использования расширяются.
Из тугоплавких металлов можно получать детали для разных областей промышленности.
Фото: onlyyouqj / фотобанк Freepik
Последняя группа тугоплавких и легирующих элементов имеет большое значение в современной металлургии и объединяет значительное число различных редких элементов. Среди них: бор (B), титан (Ti), цирконий (Zr), гафний (Hf), вольфрам (W), молибден (Mo), тантал (Ta), ниобий (Nb) и ванадий (V). Тугоплавкие металлы имеют очень высокую температуру плавления и стойкость к изнашиванию, из них можно получать детали для разных областей промышленности.
Технология извлечения редких металлов включает три стадии: разложение рудных концентратов, получение чистых химических соединений (оксидов или солей) и последующее выделение металла из его соединения.
Так как большинство редких элементов — металлы, к ним чаще применяют термин «редкие металлы». Это название более распространено и сложилось исторически, когда это были относительно новые и малоизученные элементы. Сейчас по мере освоения название носит условный характер и не означает, что распространенность этих элементов непременно мала, хотя процесс их получения остается достаточно сложным.
Но что же тогда можно назвать по-настоящему редкими веществами?
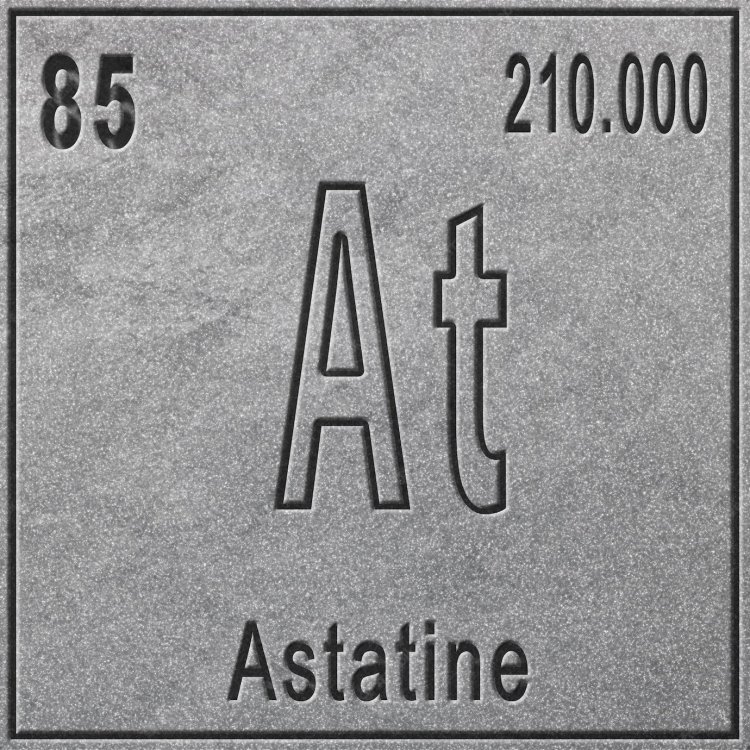
Астат
Самый редкий химический элемент на Земле — крайне радиоактивный астат (At). В переводе с греческого языка astatos означает «нестабильный». Он не случайно получил такое название. Небольшое количество астата образовывается в природе в результате радиоактивного распада урана и тория. А его общее содержание в коре всей планеты составляет менее 30 г. В своей самой стабильной форме — изотоп 210At — период полураспада составляет всего 8 часов, поэтому никто до сих пор не видел его в чистом виде. Астат не только крайне редко встречается в природе, но еще и не поддается исследованию, поэтому по праву считается самым редким веществом.
Но как исследователи его отыскали?
Существование астата было предсказано в 1869 г. Дмитрием Менделеевым. В Периодической таблице под йодом отсутствовал фрагмент, предполагалось, что там должен быть пятый галоген. Элемент №85 получил название эка-йод (Eka-Iodum).
Астат (At).
Изображение: Allexxandar / Фотобанк Freepik
Исследователи обратили внимание на то, что элементы галогенов выстраиваются сверху вниз в определенной последовательности и обладают схожими свойствами. По этому принципу астат должен быть схож с йодом, твердым галогеном. Так ученые предположили, что элемент № 85 — твердый металл. В 1920 г. немецкий химик Э. Вагнер установил еще одно свойство астата: судя по соседнему полонию (№ 84), астат должен был быть радиоактивен. А в 1926 г. немецкий радиохимик Отто Ган решил, что он может быть продуктом радиоактивного распада других элементов. Эти возможные свойства позволили задать научному сообществу направление поиска. Ученые искали его в йоде, морской воде, продуктах распада изотопов радия и радона, монаците, урановой смоляной руде, минералах железа и платины.
В 1931 г. американский ученый Ф. Аллисон с сотрудниками Алабамского политехнического института сообщили об открытии этого элемента в монацитовом песке и предложили для него название «алабамий». Оказалось, что открытие было ошибочным, как и все последующие опубликованные результаты вплоть до 1943 г. Элемент № 85 успел получить названия дор, декин, гельвеций, англогельвеций, лептин.
Но попытки обнаружить его в природе не увенчались успехом. В 1940 г. астат был впервые получен искусственно группой ученых Калифорнийского университета под руководством Эмилио Сегре. Они синтезировали элемент № 85 на циклотроне, облучив альфа-частицами мишень из висмута.
Найти изотопы астата удалось только в 1943-1946 гг. в составе природных радиоактивных руд (настуран U3O8, карнотит 2(UO2)2(VO4)2·3H2O и др.).
Большинство свойств астата до сих пор не изучены из-за сложности процедуры его получения. Известно, что астат — твердое вещество черно-синего цвета, температура плавления составляет 230 °C, кипения — 302 °C.
Но почему он не входит в ранее предложенную классификацию редких металлов?
Вероятно, это связано с тем, что для астата характерно сочетание свойств неметаллов (йод) и металлов (полоний, свинец). Поэтому вопрос отнесения его к металлам сегодня остается открытым.
Его синтезирование — сложный и дорогой процесс, поэтому пока астат не имеет практического применения. Однако ученые считают, что его можно использовать для лечения заболеваний щитовидной железы.
Калифорний
Еще один крайне редкий радиоактивный элемент — калифорний (Cf).№98 в периодической системе Менделеева. Впервые был синтезирован в 1950 г. группой американских ученых из Национальной лаборатории Лоуренса университета Беркли, штат Калифорния. Физики С. Томпсон, К. Стрит, А. Гиорсо и Г. Сиборг смогли получить его при долгом и повторном облучении плутония в атомных реакторах. Есть мнение, что в огромных количествах изотопы калифорния образуются при взрывах сверхновых звезд. На Земле в природе не встречатся. Его можно получить только искусственным путем. Сегодня применяют технологию облучения в реакторе мишеней из кюрия. Продолжительность составляет от 8 месяцев до 1,5 лет. Из полученных продуктов химическим путем выделяют калифорний.
На сегодняшний день наиболее изученный изотоп — калифорний-252 (252Cf). Он способен выделить заряд энергии, по своей мощности сопоставимый с ядерным реактором — один грамм выделяет 2,4 биллиарда нейтронов в секунду.
Калифорний-252 используется в лучевой терапии злокачественных опухолей.
Источник изображения: auntspray / фотобанк 123RF
Калифорний как мощный источник нейтронов имеет достаточно широкую область применения: его используют в нейтронно-активационном анализе и в нейтронной радиографии; в геологоразведке и при добыче полезных ископаемых; в сталелитейной, химической, нефтеперерабатывающей, угледобывающей промышленности; авиационно-космической технике и ядерной энергетике. Калифорний участвует в производстве компонентов ядерного оружия, ядерных и термоядерных зарядов малой мощности.
Изотоп 252Cf используется в лучевой терапии злокачественных опухолей. В процессе лечения атипические клетки разрушаются, здоровые не поддаются облучению.
Калифорний — один из самых дорогих элементов в мире. Цена одного грамма по разным данным составляет от $10 до $250 млн. Дороговизна оправдывается тем, что ежегодно получают всего 40-60 мг вещества.
Можно сказать, что редкие группы элементов достаточно широко используются в различных областях производства. Диапазон их применения — от космических ракет до лекарственных препаратов. Они труднодоступны: чтобы получить вещества, необходимо выделять их при помощи специальных технологий. Но распространенность таких элементов не обязательно мала.
Действительно редкими в этом смысле являются астат и калифорний.
Фото на странице: Flatart / Фотобанк Freepik
Источник изображения на главной странице: freepik / фотобанк Freepik
Источники изображений в тексте: senivpetro / фотобанк Freepik, jplenio1 / фотобанк Freepik, freepik / фотобанк Freepik, onlyyouqj / фотобанк Freepik, Allexxandar / Фотобанк Freepik, auntspray / фотобанк 123RF.